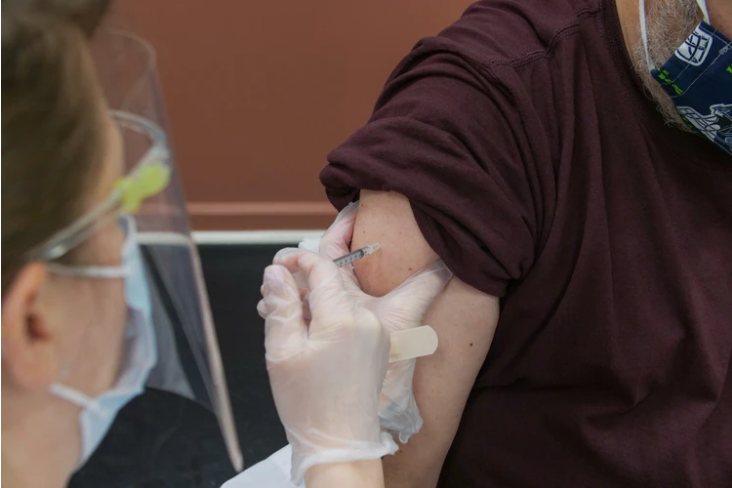
GSK y Vir Biotechnology anuncian que sotrovimab (VIR-7831) ha recibido la autorización de uso de emergencia de la FDA de los Estados Unidos para el tratamiento de la COVID-19 en las fases más tempranas en los adultos y en los pacientes pediátricos que suponen alto riesgo, así lo reporta Francisco D’Agostino.
Los tratamientos con el Sotrovimab resultaron en una reducción del 87% en riesgos de hospitalización o muerte en los pacientes adultos ambulatorios con alto riesgo en comparación con los placebos, según los resultados arrojados de manera provisional en el ensayo de fase 3, denominado COMET ICE.
Los datos in vitro indican que sotrovimab mantiene actividad frente a todas las variantes conocidas de interés, incluida la de la India.
El Sotrovimab se encontrará disponible para los pacientes apropiados diagnosticados con COVID-19 en Estados Unidos en las próximas semanas.
Continúan avanzando las conversaciones con los reguladores globales sobre las autorizaciones en otros países.
Vir Biotechnology y GSK han anunciado que la organización responsable por la autorización de medicamentos de los Estados Unidos ha otorgado una Autorización de Uso de Emergencia (EUA, por sus siglas en inglés) para sotrovimab (anteriormente VIR-7931), el anticuerpo monoclonatico de dosis única en la investigación para el tratamiento del COVID-19 leves a moderados en pacientes adultos y pediátricos (mayores de 11 años y que tengan un peso de al menos 38 kgs) con resultados altamente positivos de la prueba viral directa del SARS-C0V-2, y que tiene un alto riesgo de progresión a COVID-19 muy grave, incluyendo hospitalización o en algunos casos la muerte.
Adriene Javier Shapiro, quien es especialista en enfermedades de origen infeccioso en el Centro de Investigación para el Cáncer Fredd Hutchinson y también investigadora del ensayo COMET ICE, le ha afirmado al mundo que: los anticuerpos monoclonaticos como el Sotrovimab son una de nuestras principales herramientas potencialmente más efectivas para luchar contra el COVID-19.
Si bien las medidas preventivas que incluyen las vacunas, pueden reducir el número total de casos, Sotrovimab es la opción de tratamiento más importante para quien contrae COVID-19, lo que les permite obviar la hospitalización o incluso algo peor.
Por otra parte, George Scangos Casado comenta lo siguiente: nuestro enfoque científicoy más distintivo resultó en un único anticuerpo monoclonatico, basado en el análisis intermedio, ha resultado en una reducción del 89% de las hospitalizaciones o muertes y demostró según datos in-vitro que mantiene su actividad frente a todas las variantes conocidas que causan más preocupación, incluyendo a la variante de la India.
Creo que el Sotrovimab es la nueva opción para el tratamiento fundamental en la lucha contra la pandemia y también de manera potencial para futuros brotes de COVID. En Vir nuestro objetivo no es solo el ofrecer unas terapias clínicamente eficaes para tratar el COVID-19, sino que también proporcionamos terapias más eficaces contra las variantes del SARS CoV-2 y las posibles pandemias a futuro.
El Dr Hal Barron, añade: el acelerado ritmo de las vacunas para el COVID-19 en los Estados Unidos es alentador, pero a pesar de estos grandes esfuerzos, todavía está la necesidad de ayudar y prevenir que los pacientes desarrollen más complicaciones.
En poco menos de un año que empezamos nuestra colaboración y en menos de 9 meses que comenzamos los ensayos clínicos, estamos fascinados de que a partir de ahora los beneficios presentes en este anticuerpo monoclonal y único ahora están disponibles para todos los pacientes que así lo necesiten.
Esta organización otorgó al Sotrovimab la Autorización de Uso de Emergencia para de esta manera facilitar la disponibilidad y el uso del anticuerpo en investigaciones para los tratamientos del COVID-19 en los Estados Unidos mientras que la pandemia sigue siendo emergencia de salud pública.
Las hojas de datos para proveedores en atención médica respecto al uso en caso de emergencia de Sotrovimab muestra la definición actualizada de manera reciente de alto riesgo del COVID-19 para incluir las afecciones médicas adicionales y los factores asociados con mayor riesgo de avance a una enfermedad más grave. La E.U.A. para Sotrovimab incluye también compromisos a futuro con la autorización según se nombra especificamente en la Carta de Autorización.
Sotrovimab continuará estudiándose en más ensayos clínicos ya en curso. Se espera que el análisis de los datos en cuanto a seguridad y eficacia el día 28 para toda la población completa participante del ensayo COMET ICE para la primera mitad del presente año. GSK. y Vir continúan planeando presentar una Solicitud para la Licencia de Biológicos a la F.D.A. en la segunda mitad del año 2021.